Es una fuerza de unión entre los elementos que se unen para generar compuestos, a esto se le llama enlaces químicos, todo ésto para cumplir la ley del octeto ns2 np6 = 8 electrones, ésto brinda estabilidad química.
Los electrones de valencia son muy importantes éstos pueden ceder, recibir o compartir para buscar una estabilidad química la cuál será el enlace químico


Hay varias clases de enlaces químicos, entre éstas se encuentran:
ENLACES IÓNICOS: Se presentan cuando hay transferencia de electrones, cuando se ceden los electrones forman cationes y cuando reciben electrones forman aniones. Entre mayor sea la diferencia de electronegatividad mayor es la característica del enlace químico. Cuando la diferencia de electronegatividad es mayor a 1,7 el enlace es iónico ejemplo:
Li = Z3 = 1S2S1
Gráfica que muestra la electronegatividad
COMPUESTO IÓNICO: Es el que está formado por dos sustancias con una diferencia importante en sus electronegatividades
ENLACES IÓNICOS: es el que se da entre metales y no metales, es decir los electropositivos y electronegativos, una diferencia en electronegatividad de 1,7 sera un enlace iónico
ENLACE COVALENTE: Se presenta cuando hay comparación de electrones. Se presenta cuando la diferencia de electronegatividad es menor de 1.7.
Los enlaces covalente se definen como la unión que se producen entre dos átomos por la compartición de dos o más electrones de su capa externa con el objetivo de formar una molécula estable. Un ejempo claro es la molécula de Cloro, cuando el cloro esta en estado natural se presenta como una molécula la cuál está formado por dos átomos de cloro. estos átomos de cloro se encuentran unidos mediante el enlace covalente producido por la compartición de dos electrones.
ENLACE COVALENTE POLAR: Se produce cuando uno de los átomos presenta mayor fuerza de atracción de los electrones hacia su núcleo, generando una molécula con parte positiva y parte negativa.
Los enlaces covalentes polares siempre se producen cuando el enlace se realiza entre dos átomos diferentes.
El grado de polaridad de la molécula resultante del enlace covalente depende de la fuerza o atracción de electrones hacia un átomo, éste concepto es definido mediante la electronegatividad.
ENLACE COVALENTE APOLAR: Se producen cuando ambos átomos disponen de la misma fuerza de atracción de los electrones a su mismo núcleo.
Los enlaces covalentes apolares siempre se producen cuando el enlace se realizan entre dos átomos iguales o con el mismo grado de electronegatividad.
ENLACE COVALENTE SIMPLE: Es el que se forma cuando los átomos se unen y comparten un par de elctrones y cada uno aporta un electrón como en el caso del Cloro se presenta con la linea corta (-)
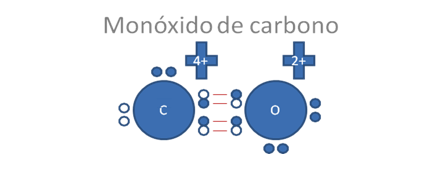
ENLACE COVALENTE DOBLE: Es el que se forma cuando los átomos que se unen comparten los dos pares de electrones y cada átomo aporta un par. Se reperesenta por dos líneas cortas (=). Por ejemplo la molécula de oxígeno, cada átomo tiene 6 electrones de valencia de modo que le faltan dos pares para completar la ley del octeto, lo que logra compartiendo dos pares de electrones
ENLACE COVALENTE TRIPLE: Es el que se forma cuando se comparten tres pares de electrones. Se repesentan por 3 línas cortas. Por ejemplo en la molécula de nitrógeno cada átomo de nitrógeno contiene 5 electrones de valencia, al compartir 3 pares de electrones completan el octeto.
ENLACE DATIVO: Es también llamado coordinado se caracteriza por que el par de elctrones que se comparten son aportados en un solo átomo por ejemplo el ácido sulfúrico





No hay comentarios:
Publicar un comentario